Current issue
코로나바이러스감염증-19백신과 뇌전증
- 김도형(정보위원, 삼성창원병원 신경과)
본격적인 코로나바이러스감염증-19 예방접종을 앞둔 시점에서 뇌전증 환자 대부분이 진료 중 백신을 맞아도 되는지 문의하는 일은 일상이 되었다. 이에 뉴스레터 지면을 빌려 대한뇌전증학회 회원들에게 코로나바이러스감염증-19백신(코로나19백신)에 대한 기본적인 안내 사항과 뇌전증환자에게 백신 접종과 관련하여 조언해야 할 내용을 정리해 보았다. 향후 백신접종 관련 자료는 수시로 업데이트되고 있어 지속적인 확인이 필요하겠다.
1. 코로나19백신의 종류
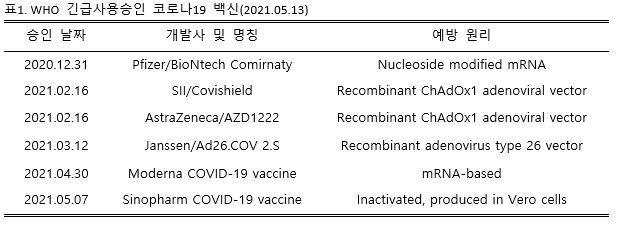
2021년 5월 기준 WHO(World Health Organization, 세계보건기구)에서 긴급사용승인을 받은 코로나19백신은 다음과 같다.(표1) 이중 국내에서 허가된 백신은 아스트라네제카社백신(2021.02.10 허가), 화이자社백신(2021.03.05 허가), 얀센社백신(2021.04.07 허가), 모더나社백신(2021.05.21 허가)이다.
2. 코로나19백신과 관련된 식품의약품안전처 주의사항
식품의약품안전처에서 공개한 코로나19백신의 기본적인 주의사항을 살펴보면, 먼저 나이 기준에 따른 적응증의 경우 화이자社백신은 16세 이상, 그 외 제약사 백신은 18세 이상이다. 백신 성분에 과민성이 확인된 경우 사용하지 않도록 규정하고 있다. 혈소판감소증이나 혈액응고장애가 있는 자, 또는 항응고치료 중인 자는 접종 후 출혈이나 멍이 발생할 수 있고, 급성중증열성질환이 있는 자 또는 급성 감염이 있는 자는 접종을 미루도록 설명하고 있지만, 감기나 가벼운 발열과 같은 경미한 수준의 감염은 접종을 지연하지 않도록 권고하고 있다. 특히, 아스트라네제카社백신의 경우 매우 드물게 탈수초질환 이상반응이 보고되었고, 뇌정맥동혈전증, 내장정맥혈전증 등 흔히 나타나지 않는 부위의 혈전증이 반복적으로 발생하고 있어 주의를 요한다. 또한, 헤파린유발혈소판감소증(Heparin-induced thrombocytopenia, HIT) 또는 항인지질증후군의 병력이 있는 환자는 아스트라네제카社백신을 투여할 경우 잠재적위험을 잘 판단하여 결정하도록 권하고 있다.
3. 코로나19백신과 이상반응
1) 일반적인 이상반응
일반적으로 백신 접종 후 열감, 오한, 근육통, 관절통, 두통 등의 전신 반응 및 주사 부위 통증, 발적, 부종 등의 국소 반응이 나타날 수 있으며, 혈압 저하나 호흡 부전을 동반한 아나필락시스 반응도 드물게 나타날 수 있다.
식품의약품안전처에서 제공한 코로나19백신별 이상반응을 살펴보면, 아스트라제네카社백신의 경우 접종부위압통(>60%), 접종부위통증, 두통, 피로감(>50%), 근육통과 권태감(>40%), 발열과 오한(>30%), 관절통과 오심(>20%)이 보고 되고 있으며, 1차 접종과 비교하여 2차 접종 후 이상반응은 발생 빈도가 적고 더 경증이다. 화이자社백신은 접종부위통증(84.1%), 피로감(62.9%), 두통(55.1%), 근육통(38.3%), 오한(31.9%), 관절통(23.6%), 발열(14.2%), 접종부위부종(10.5%), 접종부위발적(9.5%), 오심(1.1%), 권태감(0.5%), 임파선염(0.3%)이 보고되었다. 모더나社백신은 접종부위통증(92%), 피로감(70.0%), 두통(64.7%), 근육통(61.5%), 관절통(46.4%), 오한(45.4%), 오심과 구토(23.0%), 겨드랑이 부종 및 압통(19.8%), 발열(15.5%), 접종부위부종(14.7%), 접종부위 홍반(10.0%)이 보고되었다. 또한, 아나필락시스 발생율은 화이자社백신에서 백만명당 4.7명 (4.7/1,000,000), 모더나社백신에서 백만명당 2.5명 (2.5/1,000,000)이었다.
2) 혈소판감소와 혈전증
의학 학술지 New England Journal of Medicine에 발표된 논문에 따르면 아스트라제네카社백신과 얀센社백신에서 발생하는 혈소판감소동반혈전증(Vaccine-induced immune thrombotic thrombocytopenia, VITT)은 헤파린유발혈소판감소증과 유사한 기전을 보인다는 가설이 제기된 바 있다. 백신에 의해 혈소판 내에 있는 혈소판인자4(platelet factor 4, PF4)에 대한 자가항체가 발생하여 활성화된 혈소판이 혈관내피세포를 자극하여 혈전증이 발생하는 것으로 생각된다. VITT와 HIT의 발생기전이 유사함에도 불구하고 진단방법은 다르다. 일반적인 HIT라면 PF4 ELISA 검사를 통해 진단할 수 있으나, VITT의 경우에는 위음성이 나올 수 있어 국내에서 의심사례 발생시 GC녹십자 렙셀 담당자에 연락하여 검사를 진행하도록 권고한다. 치료로는 정맥내면역글로불린(Intravenous immunoglobulin, IVIG)과 고용량 스테로이드가 혈소판 수를 호전시키는데 도움이 되어 항응고제를 사용해야할 때 출혈의 위험을 낮출 수 있다.
현재 아스트라제네카社백신은 혈전증과 관련하여 유럽의약품청(European Medicine Agency)에서 위험-이득 조사를 실시 하고 있는 것으로 알려져 있다. 최근 우리나라는 하루 확진자를 500명으로 가정하였을 때 월별 유병률이 낮은감염율(Low Infection Rate, 55/100,000)에 해당한다. 현재까지 알려진 바에 의하면 여성일수록, 50세 이하일수록 위험성이 높은 것으로 보이나 근거 데이터가 충분하지 않은 실정이다.(그림 1) 다만 아직은 백신으로 인한 혈소판감소동반혈전증의 기전이 명백히 밝혀지지는 않았으므로 혈액응고장애가 있는 분들에게는 주의가 필요하다.
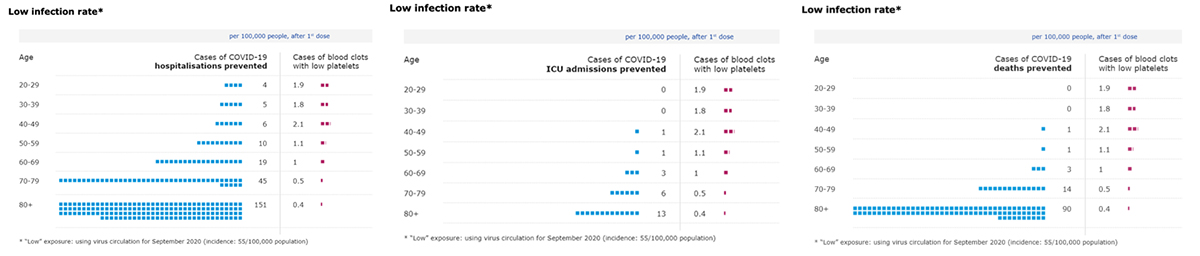
그림 1. 월별 코로나19 확진자 수가 10만명당 55명 이하인 Low infection rate 국가에서 아스트제네카社백신의 연령별 Risk-Benefit (European Medicine Agency 2021.04.23).
파란색 점은 10만명당 백신 접종이 도움이 되는 인원이고, 빨간색 점은 접종 후 VITT 발생 인원이다. 현재까지 보고된 바에 의하면 연령이 증가할수록 아래 세가지 상황에 대해 도움이 되는 인원이 늘어나고, VITT 발생 인원은 줄어든다.(좌측위: 코로나19백신으로 입원 예방 인원, 우측위: 코로나19백신으로 중환자실 입실 예방 인원, 좌측아래: 코로나19백신으로 사망 예방 인원)
3) 안면마비(Bell’s palsy)
임상시험단계에서 mRNA 백신접종 이후 안면마비 사례가 보고되었으며 미국식품의약국(United State Food and Drug Administration, US FDA)에 따르면 화이자社백신과 모더나社백신에서 각각 4건이 발생했다고 밝히고 있다.
4. 뇌전증과 코로나19백신접종
뇌전증재단(Epilepsy Foundation)에서는 뇌전증 환자의 경우 현재 건강하더라도 코로나19에 감염되어 심각한 병으로 이환될 수 있고, 주변사람에게 전파할 가능성도 있어 코로나19백신을 접종 받을 것을 권고한다. 코로나19에 감염된 병력이 있더라도 자연면역이 오래 지속되지는 않아 미국 질병통제예방센터(Centers for Disease Control and Prevention, CDC)에서는 코로나19백신을 맞도록 권유한다. 다만, 단일클론항체(monoclonal antibody)나 회복기혈장(convalescent plasma)으로 치료받았다면 90일 이후에 접종 받을 것을 권고한다. 임산부이거나 모유 수유 중이더라도 코로나19백신 접종은 가능하다. 국내 식품의약품안전처에서 배포한 주의사항에 따르면 임산부와 수유부에 대한 자료가 제한적이기에 위해성을 파악하기에 충분하지 않다. 따라서, 임신 중이라면 투여는 권장되지 않으며, 모체 및 태아에 대한 잠재적 유익성이 잠재적 위험을 상회하는 경우에만 고려되어야 하겠다. 그리고 모유수유 중이라면 모유를 먹는 영아에 대한 위해 가능성을 배제할 수 없다.
다른 위험인자 없이 경련 조절 중인 12-15세 소아뇌전증환자들에게서 백신 부작용 발생률이 동일 연령대의 일반인보다 더 높다는 근거는 현재까지 없다. 국내 식품의약품안전처에서는 5월 21일 화이자社코로나19백신 접종 허가와 관련하여 한국화이자제약사가 현행 16세 이상 허가된 투여 연령을 청소년 대상 임상시험을 근거로 12-15세를 투여 연령에 추가하기 위한 사전 검토를 신청했다고 밝혔다.
5. 뇌전증 환자의 코로나19백신 접종 시 이상반응
뇌전증재단에 의하면 아직까지 뇌전증 환자에서 이상반응 발생 위험도가 더 높다는 근거는 없다. 백신접종 이후 흔한 이상반응으로 발열이 있어서, 열에 의해 경련이 발생하는 뇌전증 환자들은 해열제를 복용하는 것이 경련 위험도를 낮추는데 도움이 될 것이다. 만약 혈소판감소동반혈전증이 발생하여 대뇌 혈류 흐름에 영향을 미치면 경련 증상이 발생할 수는 있으나 이것은 기존 뇌전증과는 다른 양상일 것이다. 또한, 발작 시 대처 계획을 미리 수립해 둘 것을 권장하고 있다.
6. 항경련제 복용과 관련 특수한 상황에서 주의사항
식품의약품안전처 주의사항에 기술한 바에 따르면 항경련제를 복용하는 환자들 중 혈소판감소증, 기타 혈액응고장애 또는 항응고치료 중인 자는 접종 후 출혈이나 멍이 발생할 수 있을 것이다. 현재까지 코로나19백신과 항경련제와의 상호작용에 대하여 보고된 바는 없다. 하지만 코로나19 백신과 항경련제와의 상호작용이 있을 것으로 추정된다는 의견은 제시된 바 있다. 화이자社, 모더나社, 아스트라제네카社백신접종 이후 T세포 반응과 인터페론 감마(IFN-)가 생성될 수 있고, 그로 인해 CYP450효소(특히 CYP3A4)의 발현이 감소될 수 있다. 따라서 CYP3A4에 의해 대사되는 카바마제핀(carbamazepine)이 코로나19백신과의 상호작용에 취약할 수 있다. 유사한 근거로, 과거 인플루엔자백신접종 이후 카바마제핀 독성이 관찰된 증례보고도 있었고, 이외 인플루엔자백신접종 이후 페니토인(phenytoin), 페노바비탈(phenobarbital), 카바마제핀 혈중농도가 증가된 보고도 있었다.
7. 코로나19백신 예방접종피해 국가보상체계 코로나19백신 예방접종 후 불가피하게 발생하는 이상반응에 대하여 국가가 안전을 책임지는 차원에서 예방접종피해국가보상제도를 운영하고 있다. 지원 대상은 인과성이 명백한 경우나 개연성이 있는 경우, 가능성이 있는 경우는 정부가 피해보상금을 지급한다. 피해조사반 또는 피해보상전문위원회에서 검토하였을 때 인과성이 인정되기 어려운 경우에도, 백신 외 다른 원인이 없는 중증환자에 한해 의료비 지원이 가능할 수 있다. 여기서 중증환자라 함은 사망, 중환자실 치료 또는 이에 준하는 치료, 장애 등이 발생한 경우를 말한다. 다만 의료비 지원을 받으려면, 예방접종 후 이상반응을 유발한 소요시간이 개연성을 보장하고, 예방접종 후 발생한 이상반응이 접종 전에는 이를 유발할 만한 기저질환, 유전질환이 불명확해야 한다. 이상반응이 의심되는 경우 예방접종도우미 누리집이나 질병관리청콜센터(1339)를 통해 이상반응을 체크하고 대응 방법을 안내 받을 수 있다.
Reference
1. CINES, Douglas B.; BUSSEL, James B. SARS-CoV-2 Vaccine–Induced Immune Thrombotic Thrombocytopenia. 2021.
2. 2. GREINACHER, Andreas, et al. Thrombotic thrombocytopenia after ChAdOx1 nCov-19 vaccination. New England Journal of Medicine, 2021.
3. KOW, Chia Siang; HASAN, Syed Shahzad. Potential interactions between COVID-19 vaccines and antiepileptic drugs. Seizure-European Journal of Epilepsy, 2021, 86: 80-81.
4. MUIR, Kate-Lynn, et al. Thrombotic thrombocytopenia after Ad26. COV2. S vaccination. New England Journal of Medicine, 2021.
5. SCHULTZ, Nina H., et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. New England journal of medicine, 2021.
6. SCULLY, Marie, et al. Pathologic antibodies to platelet factor 4 after ChAdOx1 nCoV-19 vaccination. New England Journal of Medicine, 2021.
7. SHIMABUKURO, Tom T.; COLE, Matthew; SU, John R. Reports of anaphylaxis after receipt of mRNA COVID-19 vaccines in the US—December 14, 2020-January 18, 2021. Jama, 2021, 325.11: 1101-1102.
8. US Food and Drug Administration (FDA). Fact sheet for healthcare providers administering vaccine: Emergency Use Authorization (EUA) of the Moderna COVID-19 Vaccine to prevent coronavirus disease 2019 (COVID-19). https://www.fda.gov/media/144637/download. Published March 31, 2021a. Accessed April 2, 2021.
9. US Food and Drug Administration (FDA). Fact sheet for healthcare providers administering vaccine: Emergency Use Authorization (EUA) of the Pfizer-BioNTech COVID-19 Vaccine to prevent coronavirus disease 2019 (COVID-19). https://www.fda.gov/media/144413/download. Updated May 10, 2021c. Accessed May 10, 2021.


